

Hızlı aksiyon alabilmek için yeni yönetmelik için hazırlıklar tamamlandı. Önümüzdeki yıllar için tüm dokümantasyonlarımız, gerekli değerlendirmelerimiz ve risk analizlerimiz hazır. EC sertifikamız 2019 yılında yenilenmiştir ve 2024 yılına kadar geçerlidir. MDR’nin uygulama tarihinden (26 Mayıs 2021) önce üretim süreçlerinde önemli değişiklikler yapılmaktadır ve ürünlerimiz için en az 1 yıl önemli bir değişiklik öngörmüyoruz.

Yasal yükümlülükler gereği Avrupa Mevzuatına uymak zorundayız.

Türkiye’deki yasal çerçeve, 7 Haziran 2011 tarihinde yürürlüğe giren 90/385/EEC ve 93/42/EEC sayılı Avrupa Konseyi Direktiflerine dayanmaktadır. Mevzuat, AB düzenlemelerine tamamen uyarlanmıştır.
Avrupa Birliği ile Türkiye arasındaki özel anlaşmaya göre, Türkiye’de üretilen tüm tıbbi cihazlar, yasaların gerektirdiği şekilde MDD’yi karşılamalıdır.
Türkiye, AB Tıbbi Cihaz Direktifi’ni 3 direktife ayırmıştır: Tıbbi Cihazlar Direktifi, Aktif İmplante Edilebilir Tıbbi Cihazlar Direktifi, İn-Vitro Tanı Cihazları Direktifi.
Yetkili mercimiz Türkiye İlaç ve Tıbbi Cihaz Kurumu’dur. Tüm raporlamalarımız, yetkimiz aracılığıyla Avrupa Komisyonu’na yapılmaktadır.
MDD 1992 yılında yasalaştığında, tıbbi cihazlar şimdiki gibi çeşitli değildi. Yeni teknolojilerle birlikte sektör değişti. Cihazları karakterize eden engelliler gibi cihazlarda yaşanan bazı zorluklar nedeniyle yeni bir mevzuata ihtiyaç duyulmuştur.
Önceki direktife göre, AB üyeleri direktifi kendi yasalarına uygun olarak yorumlamak ve yasallaştırmak zorundaydı. Üye devletler artık bu yeni düzenlemeyi kendi hukuk sistemlerine çevirerek doğrudan uygulamaya koymak zorundadırlar.
Mayıs 2017’de, Avrupa Parlamentosu ve Konseyi’nin 5 Nisan 2017 tarihli tıbbi cihazlara ilişkin (AB) 2017/745 sayılı Tüzüğü “AB Tüzüğü”, Mayıs 2021’e kadar bir geçiş dönemi ile yürürlüğe girmiştir.
T.C. Sağlık Bakanlığı tarafından AB yönetmeliğine dayalı olarak bir yönetmelik taslağı hazırlanmış ve Komisyon’un onayına sunulmuştur.

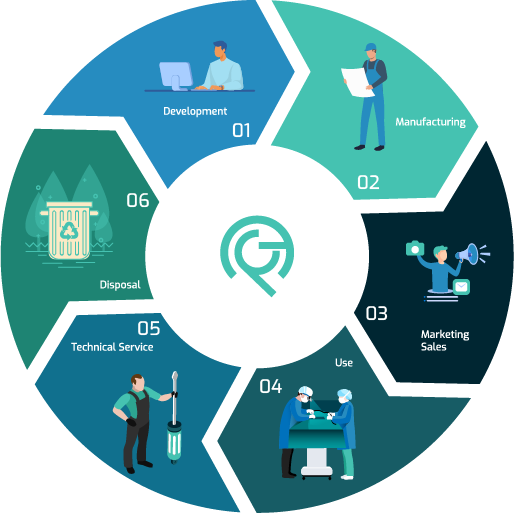
ACF Medical, daha kaliteli bir sistem için tüm gereksinimleri karşılar. Yeteneklerimiz, tıbbi bir cihazın tasarımı ve geliştirilmesi, üretimi, depolanması ve dağıtımı, kurulumu veya servisi dahil olmak üzere şirketimizin her bir parçasında görülebilir.
Kalite yönetim sistemimizde süreçlerin izlenmesi, sürdürülmesi ve kontrol edilmesiyle kilit sorumluluklar muhasebeleştirilir. Fabrikamız, teknolojideki değişiklikler ve yasal gereklilikler ve beklentiler dahil olmak üzere en son kalite yönetim sistemi uygulamalarına yanıt verecek şekilde tasarlanmıştır.
Referans alınan standartlardan biri olan ISO 14971 standardı kalite sistemimizde önemli bir yere sahiptir. Tüm kalite sistemi rehber dokümanlara dayalı olarak her zaman güncel tutulmakta, bu sayede riskleri etkin bir şekilde yönetebilmekteyiz. Ayrıca standart, tedarikçilerimizi risklere göre değerlendirmek için yazılı sözleşmeler gibi kontrolleri devreye sokarak dış kaynak kullanımı süreçlerimizde daha katı olmamızı istiyor.
Dünyanın en iyi danışmanlarından eğitim alan ISO 13485 uzmanlarımız sayesinde güvenli ve etkin tıbbi cihazlar sağlanmakta, müşteri ve mevzuat gereklilikleri yerine getirilmektedir. Müşteri şikayetlerinin ele alınması ve düzenleyici raporlama dahil olmak üzere esas olarak pazar sonrası faaliyetlere odaklanıyoruz.
Ülkeler, vatandaşlarına iyi düzeyde bir sağlık sistemi sunabilmek için hastalarının güvenliğini göz önünde bulundurarak kendi düzenleyici sistemlerini oluşturmak istemektedirler. Hükümetler, yüksek kaliteli, uygun fiyatlı ürünlere erişimden, güvenli ve uygun kullanım ve imhaya kadar tıbbi cihazlarla ilgili tüm unsurları ele alacak politikalar uygulamaktadır. Bu nedenle uygun koşullar sağlanmadığında hastalar için yüksek risk içeren tıbbi cihazlar, üreten veya ithal eden ülkeler için anahtar cihazlardır. Ülkelerin farklı ihtiyaçları olduğu açıktır. Bazen bu ihtiyaçlara bazı farklı mevzuatlarla cevap verilmesi gerekmektedir.
Devletler, ürünlerini sahada takip edebilen, cihazın tüm risk analizlerini tamamlamış, en yüksek kalite ve güvenlik standartlarına sahip firmaların ülkelerinde ürün satmasını istemektedir.
Gelişmiş tıbbi cihaz düzenleyici sistemleri uygulamak isteyen tüm ülkeler, teknik destek sağlamadaki rolünü güçlendiren Dünya Sağlık Örgütü (WHO) tarafından teşvik edilmektedir.

Dünya çapındaki distribütörlerimizle ürünlerimiz birçok ülkede tescil edilmiştir.
ISO 13485 bize, özellikle kalite sorunlarının erken uyarısını sağlamak ve tıbbi cihazlarımız için düzeltici ve önleyici faaliyet süreçlerine girdi sağlamak için bir geri bildirim sistemine duyulan ihtiyacı zorlayan bir kalite yönetim sistemi (QMS) yapısının ana hatlarını vermektedir.
Yeni Avrupa Tıbbi Cihaz Yönetmeliğine (MDR) göre Pazar Sonrası Gözetim çok önemli hale geldi.

Veri analizi ekibimiz sayesinde arıza trendlerini analiz etme yöntemimizi geliştirmeye çalışıyoruz. Özel yazılımımız, belirli müşteri sorunlarını azaltma veya ortadan kaldırma fırsatlarını temsil edebilecek eğilimleri ve kalıpları belirlemek için şikayet kaydı verilerini analiz etmemize olanak tanır.
Birincil hedeflerimiz, müşterilere beklenen faydaları gösteren saha eylemlerinden ve projelerden elde edilen bulguları özetlemek ve önceliklendirmektir. Post-Market ekibi, potansiyel ürün uyumluluğu sorunları hakkında derin işlevler arası kök neden araştırmalarına öncülük ediyor ve sonuçları şirketimiz içindeki farklı işlevler ve düzeyler arasında iletiyor.
Risk yönetimi ekibiyle, Pazar Sonrası sistemlerini ve süreçlerini iyileştirmek için risk yönetimi belgelerine ve risk yönetimi metodolojisine güncellemeler getiriyoruz.
Nitelikli veri incelemesi (QDR) periyodik toplantılarında planlar, hazırlar, bulguları gözden geçirir ve tartışırız. Ana hedeflerimizden biri Arıza Analiz Mühendisliği (FAE) ve diğer departmanların sahip olduğu QDR faaliyetlerini sonuçlandırmaktır.